类Fenton反应中吸光度变化及过氧化氢的分解动力学研究
| 论文类型 | 技术与工程 | 发表日期 | 2001-11-01 |
| 来源 | 第二届环境模拟与污染控制学术研讨会 | ||
| 作者 | 高迎新,杨敏 | ||
| 摘要 | 高迎新 杨敏 (中国科学院生态环境研究中心,环境水化学国家重点实验室,北京 100085) 酸性条件下过氧化氢能被二价铁离子(称为Fenton试剂)和三价铁离子(称类Fenton试剂)催化分解并产生氧化能力很强的羟基自由基,这一反应已经在有机合成化学和废水处理中得到比较广泛的应用(Walling, 19 ... | ||
高迎新 杨敏
(中国科学院生态环境研究中心,环境水化学国家重点实验室,北京 100085)
酸性条件下过氧化氢能被二价铁离子(称为Fenton试剂)和三价铁离子(称类Fenton试剂)催化分解并产生氧化能力很强的羟基自由基,这一反应已经在有机合成化学和废水处理中得到比较广泛的应用(Walling, 1975)。在Fenton反应体系中,亚铁离子与过氧化氢接触后迅速被氧化成三价铁离子,随后的H2O2分解反应实际上是在三价铁控制下进行的。可见类Fenton反应在H2O2催化分解过程中有着非常显著的意义。
近年来有关类Fenton反应的研究比较多,eq.1-4所示的主要反应步骤已被多数学者接受。有关H2O2分解动力学以及对H2O2分解动力学有着重要影响的铁离子中间络合形态的研究也有一定的报告 (Barb, 1949,1951; Walling, 1974;De Laat et al, 1999)。然而,至今为止还没有一个得到广泛承认的动力学表达式。
Fe3+ + H2O2 → Fe(OOH)2+ + H+ (1)
Fe(OOH)2+ →Fe2+ + HO2· (2)
Fe2+ + H2O2 → Fe3+ + HO· + HO- (3)
Fe3+ + HO2· →Fe2+ + O2 + H+ (4)
本文根据类Fenton反应中吸光度的变化对三价铁的络合形态进行了系统研究,根据实验结果提出了一种新的中间产物假设并利用吸光度以及自由基浓度的变化进行了验证。同时,对H2O2分解动力学进行了研究,并计算了动力学参数。
1 实验部分
1.1 材料
(1)0.1mol·l-1 Fe2(SO4)3储备液:取一定量的Fe2(SO4)3溶于一定体积的去离子水中,用EDTA滴定法测定其浓度。储备液当天使用当天配制。
(2) 0.3mol·l-1 H2O2 贮备液:取一定量30%的H2O2用去离子水稀释,以硫代硫酸钠标定其浓度并避光保存。
(3)DMPO溶液(5,5-二甲基-1-吡咯啉基-氮氧化物):取一定量的DMPO配制成50mmol/l。
1.2 主要仪器:U-3010(HITACHI)紫外可见光分光光度计,SPM-10 pH 计,HITACHI Z-6100型原子吸收仪,Bruker ER-200D-SRC分光光度计。
2 实验结果与讨论
2.1不同 H2O2浓度对吸光度的影响
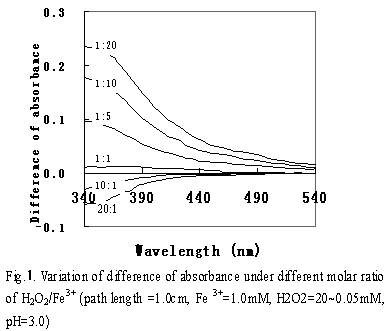 图1是以1.0mM、pH3.0的铁溶液为空白,对加入不同浓度H2O2的铁溶液进行波长扫描的结果。pH3.0时Fe(III)主要以Fe(OH)2+形式存在,Fe(OH)2+在290-400nm之间有较强的吸收。加入H2O2后,当H2O2/Fe3+为1:1时,吸光度差接近于零。随着H2O2/Fe3+的降低,吸光度差有递增趋势,表明有吸光系数大的物质产生,该物质可能就是De Laat et所推测的物质Fe(OH)OOH+。当H2O2/Fe3+大于1:1以上时,随着H2O2/Fe3+的增大,吸光度差呈负的递增趋势,表明随着H2O2比率的增加,出现了一种吸光度小的物质,该物质可能以类似于 Fe(OH)2+-H2O2络合物的形式存在。式5和6是溶液中可能发生的反应。
图1是以1.0mM、pH3.0的铁溶液为空白,对加入不同浓度H2O2的铁溶液进行波长扫描的结果。pH3.0时Fe(III)主要以Fe(OH)2+形式存在,Fe(OH)2+在290-400nm之间有较强的吸收。加入H2O2后,当H2O2/Fe3+为1:1时,吸光度差接近于零。随着H2O2/Fe3+的降低,吸光度差有递增趋势,表明有吸光系数大的物质产生,该物质可能就是De Laat et所推测的物质Fe(OH)OOH+。当H2O2/Fe3+大于1:1以上时,随着H2O2/Fe3+的增大,吸光度差呈负的递增趋势,表明随着H2O2比率的增加,出现了一种吸光度小的物质,该物质可能以类似于 Fe(OH)2+-H2O2络合物的形式存在。式5和6是溶液中可能发生的反应。
Fe(OH)2++H2O2→Fe(OH)2+-H2O2 (5)
Fe(OH)2+-H2O2→Fe(OH)OOH+ + H+ (6)
2.2吸光度与反应时间的关系
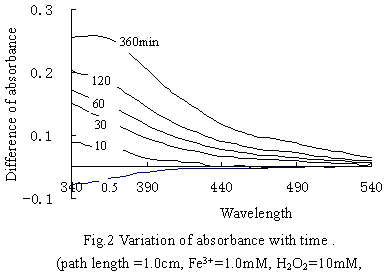
图2为吸光度差随反应时间的变化。可以看出,溶液的吸光度随着H2O2的分解而逐渐增大。随着H2O2浓度的降低,可能是Fe(OH)2+-H2O2逐渐分解而形成吸光度较高的中间产物Fe(OH)OOH+。
2.3 H2O2 浓度对自由基产量的影响
类Fenton反应中产生的OH·自由基已经通过ESR(电子自旋共振波谱)得到证实。本研究结果表明,自由基的产生量随着H2O2/Fe(III)增加而逐渐减少,也就是说H2O2的分解速率随着H2O2浓度的增加而下降。这一结果间接证明了类似于 Fe(OH)2+-H2O2络合物的存在。H2O2浓度越高,Fe(III)被络合得越稳定从而降低了它的活性。
2.4 H2O2分解动力学研究
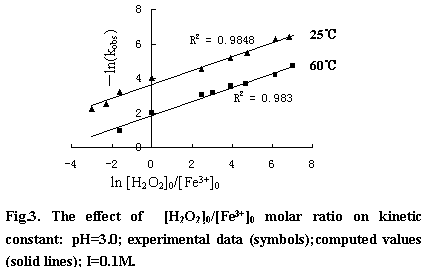
类Fenton反应中,H2O2的分解属假一级反应。在pH1-2.8范围内随着pH的增大反应速率常数也随着增大。随后再随着增大而减少。最佳范围为pH2.5-3.5(图略)。H2O2的分解速率也受溶液中阴离子种类的影响,在相同离子强度下,影响程度依次为:磷酸根>>氯根>硝酸根>高氯酸根。它们对H2O2分解速率的影响可能与其同铁离子的亲合力有关,亲合力越大的阴离子其影响也就越大。图3为H2O2分解速率常数与[H2O2]0/[Fe3+]0的关系。可以看出,反应速率常数与[H2O2]0/[Fe3+]0成指数关系。根据Arrhenius 公式求得速率常数公式:
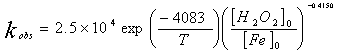
3.结论
1.根据吸光度的变化,可以推测出在类Fenton反应有类似于[ Fe(OH)-H2O2的络合物存在。类Fenton反应中吸光度随时间的变化和自由基的产量变化也间接地支持这一推测。
2.类Fenton反应中,H2O2的分解属假一级反应。最佳pH范围是2.5-3.5。
3.不同阴离子对H2O2的分解速率影响也不一样,其影响顺序为:磷酸根>>氯根>硝酸根>高氯酸根。H2O2的分解速率与(H2O2/Fe3+)摩尔比成一定有指数关系。
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








