表面流人工湿地中氮磷的去除机理
| 论文类型 | 技术与工程 | 发表日期 | 2006-03-01 |
| 作者 | 张军,周琪,何蓉 | ||
| 关键词 | 人工湿地 氮磷 去除机理 | ||
| 摘要 | 人工湿地作为一种高效、低耗的污水处理新工艺已被广泛接受,特别是其在脱氮、除磷方面的应用逐步为人们所重视。本文深入地讨论了表面流人工湿地中各种生物、物理、化学过程对污水中各种形态含氮、含磷化合物的去除机理,及其具体途径、相关反应和反应类型,总结了国内外对各个过程影响因素、控制条件、反应速度、去除能力及相互之间协调拮抗作用的研究结果。虽然硝化/反硝化作用和土壤吸附沉淀作用已被公认为是表面流人工湿地脱氮、除磷的主要途径,但不同研究结果之间仍存在着明显差异,鲜有多介质环境条件下各种脱氮、除磷过程中多种氮、磷形态的 | ||
目前,我国城市污水处理普遍采用活性污泥法、氧化沟法、间歇性活性污泥法等。我国处理污水造价在1000 元/t以上,运行费用在0.3~1.2 元/t 之间,而我国2050 年以前要投入建设的污水处理厂还需投资1000亿元左右,再加上管网费用需投资2000 亿元,那么年运营费用近100亿元[1]。由于高昂的投资和运行费用,使得各种二级、三级处理技术难以大面积推广。事实也说明,单纯依靠传统的人工处理方法在我国当前的情况下尚难以从根本上解决水污染的问题,只能延缓其发展趋势。20 世纪70 年代以来,人工湿地处理技术的提出和发展,为综合解决上述问题提供了一种新的选择。人工湿地作为一种新型生态污水处理技术,具有投资和运行费用低(仅为传统二级污水厂的1/10 至1/2)、抗冲击负荷、处理效果稳定、出水水质好,芦苇可以利用(作为造纸原料)等诸多优点。因此人工湿地技术不失为我国经济尚欠发达、地理条件相对宽裕的广大中小城镇、居民小区污水处理的优选方案。从近年来国内外的研究进展,特别是国内如火如荼的开发应用,以及包括去污机理、动力学模型等理论的进一步成熟,人工湿地作为一种经济有效的污水处理手段,必将成为我国污水处理的重要工艺而得到广泛应用[2]。
1 表面流人工湿地在污染控制中的应用
表面流人工湿地通常是利用天然沼泽、废弃河道等洼地改造而成的,其底部有由粘土层或其它防渗材料构成的不透水层,以防止有害物质对地下水造成的潜在危害,填以渗透性良好的土壤(10-6~10-7 m/s),生长着各种挺水、潜水植物,污水以比较缓慢的流速和较浅的水深流过土壤表面,经过表面流人工湿地系统中各种生物、物理、化学作用,从而得到净化。目前,表面流人工湿地已经广泛地应用于处理生活、养殖污水[3],蓄积和净化暴雨径流[4],利用人工湿地控制面源污染[5],恢复和重建河流、湖泊湿地[6],在线净化受污河、湖水[7]等各个方面。特别是表面流人工湿地在外观形式和功能结构上都十分类似于天然湿地系统,污水中的营养元素可以促进植物生长,有机污染物可以通过微生物的分解利用后,通过食物链的传递为各种动物提供食物,从而使其成为一个经过人工强化的、生物多样性极其丰富的自然生态系
统,可以为迁徙过冬的鸟类和各种湿地生物提供充足的食物和生活空间[8]。因此,对表面流人工湿地系统的研究、开发和应用,既可以为综合解决传统二级处理脱氮除磷效率不高,三级处理投资运行费用昂贵提供一种新的选择,又可以为保护、利用、恢复目前日渐萎缩和退化的自然湿地面积提供一个全新的解决方式[9]。
2 表面流人工湿地中氮的去除机理
含氮化合物在表面流人工湿地中的循环变化过程如图1所示。

表面流人工湿地中含氮化合物主要包括颗粒有机氮(particulate organic nitrogen)、溶解有机氮(dissolved organic nitrogen)、氨态氮(NH4+-N、NH3-N)和硝态氮(NO2--N、NO3--N)。一般进入表面流人工湿地的城市污水中的总氮约有50%的质量分数是有机氮,余下的主要是有机氮在下水道中被微生物降解后的产物NH4+-N[10]。同时各种植物的枯萎,藻类、细菌、附着微生物等的死亡,也是表面流人工湿地中PON 的又一重要来源。这些PON 在进入表面流人工湿地以后会最终沉淀于水层底部,被腐殖层和土壤中的微生物通过氨化作用(ammonification)降解成为氨态氮又返回水体之中,少量难降解PON 逐渐稳定、沉积成为新的湿地土壤。
有机氮转化成氨态氮的过程是由温度和pH 控制的,有研究表明城市污水中的有机氮在11~14 ℃条件下,经过19 h 就会全部转化成氨态氮[11]。
在水中,氨态氮的两种存在形式(NH3和NH4+)之间的平衡转化主要是受温度和pH 的影响。例如,在25℃、 pH=7 的条件下,NH3的质量分数只占0.6%,因此NH4+-N
是表面流人工湿地中氨态氮主要的存在形式。在无植物覆盖和遮挡的开阔水面中,藻类的大量繁殖可以导致pH 上升,从而使氨态氮的平衡向NH3转移,加速氨态氮向大气的挥发,在经过优化设计的塘系统中这一过程对总氮去除效率的贡献最高可达50%以上,但是由于表面流人工湿地设计和构造的出发点不同,一般这一过程的作用并不显著[12]。因此,水中的NH4+-N主要通过在好氧环境中被微生物通过硝化作用(nitrification)转化成硝态氮而去除,每转化1g NH4+-N 成NO3--N,需要消耗4.3 g O2 和7.14g碱(以CaCO3 计)[10]。
因此,在进行FWS 系统溶解氧平衡计算时应注意将硝化耗氧量(NOD)计入。由于NO2--N和NO3--N不能被土壤以离子交换、吸附等方式结合,因而主要存在于表覆水(surface water or overlying water)和土壤间隙水(sediment pore water)中,被植物和好氧微生物吸收利用去除,或被反硝化还原成气态氮(N2、N2O)而进入大气。微生物和藻类的吸收和利用速率未见报道,但它们的残体在死亡后很快就被分解,生长所吸收利用的N 几乎全部返回水体,因此这一过程对脱氮效果影响不大。芦苇和香蒲对NO3--N的吸收速率分别约为N 0.5 g/(m2·a)和3.3 g/(m2·a)[13]。Bachand 等的研究表明,虽然植物本身所吸收的氮质量不足TN 去除量的10%,但不同的植物对FWS 脱氮效果的影响很大,这一方面说明反硝化作用才是氮去除的主要过程,同时也间接地证明了腐败的植物残体为在腐殖层和湿地土壤中发生的反硝化提供了重要的有机物来源。
反硝化(denitrifacation)是细菌在厌氧或缺氧环境中分解利用有机物产能时,将NO2--N和NO3--N代替O2作为电子受体,最终生成气态氮(N2、N2O)的一种生物化学反应,每反硝化1 g NO3--N成N2,需要消耗相当于2.86g BOD的有机物并产生3.0 g 碱(以CaCO3 计)[14],可能发生反硝化的最小碳氮质量比为1。这一过程一般发生在出在缺氧或厌氧条件下的腐殖层和湿地土壤中,由于腐败的植物残体是湿地土壤中有机质的主要来源[15],因此,微生物反硝化时所利用的主要碳源是植物残体腐败时所释放出来的有机物,而不是随污水进入FWS 中的有机物质。反硝化所需的w(C)/w(Ndeni)根据有机物降解难易程度的不同而介于(3∶1)~(70∶1),植物残体可降解的难易程度又与其w(C)/w(N)和纤维含量有关。例如,一般潜水植物和漂浮植物死亡后,60d 内会损失掉70%~80%的生物量[16],而纤维含量较多的香蒲则需要1a 的时间才能损失掉同样数量的生物量[17]。
由上述硝化/反硝化过程的发生机制可知,虽然潜流型人工湿地系统在处理硝态氮含量高、氨态氮基本去除的二级出水或暴雨径流时,反硝化脱氮效果比较理想,但是由于潜流型人工湿地系统始终处在一个缺氧和厌氧环境下,且系统中碳源的分布并不与反硝化作用活跃的区域同步,所以当处理只经过简单沉淀或一级处理的生活污水时,表面流人工湿地系统的优势往往更容易得到体现[18]。
生物固氮作用可以同时在好氧和厌氧环境中,通过生活在水、腐殖层和土壤中细菌、蓝藻等各种微生物完成。这一过程是天然湿地中氮的主要来源,但在接收和处理污水的表面流人工湿地系统中这一过程并不显著[19]。
氮在表面流人工湿地中的去除过程主要有挥发、土壤吸附和离子交换、植物吸收、硝化反硝化。前两个过程的去除作用并不显著。而植物吸收的去除只占总质量的10%左右,且必须通过收获才能离开表面流人工湿地系统。这种管理方式费用较高,一旦植物被收获,则在腐殖层和土壤中依赖植物残体分解提供有机物而进行的反硝化作用会受直接影响,从而影响反硝化脱氮的效果。因此设计的时候必须要保障水中有充足的溶解氧以完成NH4+-N的硝化,同时又要使反硝化细菌有适宜的厌氧缺氧环境和充足的有机物来源,以保障反硝化脱氮这一表面流人工湿地系统中主要脱氮途径的顺利进行。
3 表面流人工湿地中磷的去除机理
含磷化合物在表面流人工湿地中的循环转化过程如图2 所示。
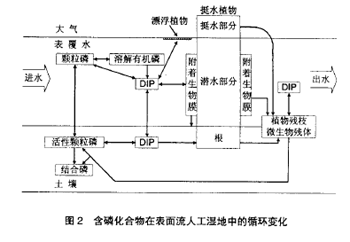
进入表面流人工湿地系统中的含磷化合物主要包括颗粒磷(particulate phosphorus)、溶解有机磷(dissolved organic phosphorus)和无机磷酸盐(dissolved inorganic phosphorus)。
多年的研究表明,人工湿地能够利用土壤、微生物、植物这个复合生态系统的物理、化学和生物的三重协调作用,通过过滤、吸附、共沉、离子交换、植物吸收和微生物分解 来实现对污水中磷元素的高效去除,其中生化过程有:(1)植物、附着微生物、其它微生物的吸收;(2)植物枯枝和土壤有机磷的稳定化(矿化)[20]。非生物过程有:(3)沉积作用;(4)吸附和沉淀作用;(5)土壤和表覆水之间的扩散交换作用[21]。
各种附着生长和悬浮在水中的微生物,在生长繁殖过程中可以吸收和利用污水中的无机磷酸盐,Wang 等[22]的研究表明,通过污水进入表面流人工湿地中的磷(P)大约有质量分数为14% [0.117~0.220 g/(m2·a1)]被微生物吸收利用,而且这部分磷在微生物死亡后几乎全部被迅速分解释放,回到水体当中,所以一般认为微生物的活动与TP 的去除效率之间并无显著相关,但是有机磷酶促水解无机化,却是表面流人工湿地系统中磷被土壤吸附沉淀和植物吸收利用的关键一步[23]。
湿地植物在生长季节,可以将通过扩散交换过程由表覆水通过表层土壤进入深层土壤间隙水中的无机磷酸盐吸收利用,重新将磷“泵回”地表以上,成熟的表面流人工湿地中植物、表层土壤和深层土壤三者之间处于一种动力学平衡状态,使得表层土壤与表覆水之间的交换吸附磷的能力不断得到恢复,因而有植物系统比无植物系统有着更好的磷去除效果[24]。植物对磷的吸收速度和蓄积能力因植物种类的不同而各不相同,Brix[25]研究表明,一些水生植物对磷(P)的吸收蓄积能力可达3~5 g/(m2·a1)。但是这部分储存在植物体内的磷又会在秋冬季节随着植物的枯萎死亡,部分被微生物缓慢分解重新释放回水体当中,其余部分则逐渐积累稳定成为腐殖质。腐殖质及其吸附的磷可占土壤总磷含量的40% 以上[26],这部分含磷物质在好氧条件下很容易被植物吸收而重新利用,但是在厌氧条件下却不会被生物酶所分解,可以稳定地蓄积和保存,成为磷去除的一个重要途径[27]。有关研究发现植物收获的频率与磷的去除效率直接相关,有规律的收获,可以使表面流人工湿地系统中植物对磷的吸收占总磷去除率的20%~30%[28]。不过亦有学者[29]指出,植物的收获短期内会使表面流人工湿地系统出水中磷的浓度升高,并且植物吸收的磷只占总磷去除效率的10%左右,而50%的植物体是生长在土壤之下的,所以通过收获从表面流人工湿地系统中取出的磷不足总磷去除效率的5%。有的研究还表明湿地底层中累积、腐败的植物残体仍具有吸附结合和促进共沉淀含磷化合物的作用,可以给人工湿地系统带来新的磷吸附能力[30]。而且在植物枯萎的过程中,储存在植物地表以上茎叶中的磷会有相当一部分被转移到其在地下的器官当中[17]。加之费用、管理和植物处置上的问题,因而这种管理方式在实际应用当中并不可取。
湿地土壤一直被公认为是进入湿地系统的磷的最终归宿[14]。首先吸附在悬浮颗粒物(suspended solid)上的磷进入表面流人工湿地后,随着SS 的沉淀而去除。而水中的无机磷酸盐通过扩散交换进入土壤间隙水后,可以通过下面两个过程被去除:
(1)直接与间隙水中的Ca2+、Fe3+、Al3+离子,及其水合物和氧化物反应,生成难溶化合物,经过互相聚合或吸附在土壤颗粒上,形成新的土壤[14];
(2)带负电的磷酸根很容易被带正电的粘土颗粒所吸附,进而与粘土颗粒表面水合的Ca2+、Fe3+、Al3+离子发生离子交换而被结合,并能与土壤中的硅酸盐发生置换而进入粘土颗粒的晶格当中[31]。
因此,湿地蓄存磷的能力主要靠土壤对磷的吸附及其理化性质的决定,磷的去除率与湿地土壤类型密切相关[32]。湿地土壤中有机质、Ca、Fe、Al 的质量分数及土壤通透能力等会极大地影响表面流人工湿地对磷的去除效率,尤其是铁铝氧化物含量更是决定着土壤对磷吸附能力的大小[33]。同时,湿地土壤中的氧化还原电位也对土壤对磷的吸附有着很大的影响。例如,在还原环境中,Fe(Ⅲ)将被还原成Fe(Ⅱ),从而使与之结合的磷形成的化合物的溶解度升高,从而导致磷的释放。植物的输氧作用所形成的好氧环境也是则会促进湿地土壤对磷吸附、沉淀、蓄积稳定,这也是有植物系统能够有更好的除磷效果的一个重要原因[30]。
但磷的去除效果对水力负荷的变化十分敏感,去除效果在湿地土壤吸附交换达到平衡后明显下降[30]。然而,已有研究表明湿地土壤在经过一定一个月的“休息”和与空气接触,可以恢复74%左右的蓄磷能力[34]。
4 结语
综上所述,通过近几十年来国内外专家学者对表面流人工湿地系统的深入研究,我们已经对表面流人工湿地中氮、磷去除的各种生物、物理、化学途径及其影响因素、控制条件有了比较清楚的了解,但是由于表面流人工湿地系统本身的复杂性、污水性质的不确定性,以及各个研究者采用的研究手段和方法的不同,导致研究结果之间存在着很大的差异。而且对BOD 去除、硝化作用和土壤除磷所需的好氧环境与反硝化作用所需的缺氧厌氧环境所需条件在空间分布上的冲突,以及土壤除磷能力的恢复机理,尚缺乏微观环境的认识和合适的解决手段,所以利用表面流人工湿地进行污水处理的风险性和不确定因素会增加,远期的效果得不到保证。这在很大程度上影响了这一技术的广泛应用。因此,尚需深入、系统地对表面流人工湿地脱氮除磷机理进行多介质条件下多种氮磷形态的质量平衡、定量化和模型化研究。
参考文献:
[1] 王琳, 杨鲁豫. 我国城市污水处理的有效措施[J]. 城市环境与城市生态, 2001, 14(1): 50-52.
[2] 王薇, 俞燕, 王世和. 人工湿地污水处理工艺与设计[J]. 城市环境与城市生态, 2001, 14(1): 59-62.
[3] JUWARKAR A S, OKE B, JUWARKAR A, et al. Domestic wastewater treatment through constructed wetland in India[J]. Wat Sci Tech, 1995, 32(3): 291-294.
[4] 徐丽花, 周琪. 人工湿地控制暴雨径流污染的实验研究[J]. 上海环境科学, 2002, 21(5): 274-277.
[5] BRASKERUD B C. Factors affecting phosphorus retention in small constructed wetlands treating agricultural non-point source pollution[J]. Ecol Eng, 2002, 19: 41-61.
[6] HUNT P G, STONE K C, HUMENIK F J. In-stream wetland mitigation of nitrogen contamination in a USA Coastal Plain stream[J]. J Environ Quality, 1999, 28(1): 249-256.
[7] DE CEBALLOS B S O, OLIVEIRA H, MEIRA C M B S, et al. River water quality improvement by natural and constructed wetland systems in the tropical semi-arid region of Norhteastern Brazil[J]. Wat Sci Tech, 2001, 44(11-12): 599-605.
[8] MC ALLISTER L S. Habitat Quality Assessment of Two Wetland Treatment Systems in the Arid West: Polit Study (EPA/600/R-93/117)[R]. Corvallis, OR: US EPA, Environment Research Laboratory, 1993.
[9] KADLEC R H. Overview: surface flow constructed wetlands[J]. Wat Sci Tech, 1995, 32(3): 1-12.
[10] US ENVIRONMENT PROTECTION AGENCY. Manual: Nitrogen Control (EPA/626/R-93/010) [R]. Cincinnati, Ohio: Office of Research and Development, 1993.
[11] BAYLEY R W, THOMAS E V, COOPER P F. Some problems associated with the treatment of swerage by non-biological processes[A]. In: ECKENFELDER W W, CECIL L K, eds. Applications of New Concepts in Physical-Chemical Wastewater Treatment[C]. Oxford, UK: Pergamon Press, 1973: 119-132.
[12] US ENVIRONMENT PROTECTION AGENCY. Wastewater Stabilization Ponds: Nitrogen Removal[R]. Washington, DC: Office of Water, 1983.
[13] BURGOON P S, REDDY K R, DEBUSK T A, et al. Vegetated submerged beds with artificial substrates: Ⅱ. N and P removal[J]. J ASCE-EED, 1991, 117(4): 408-424.
[14] US ENVIRONMENT PROTECTION AGENCY. Manual-Constructed Wetlands Treatment of Municipal Wastewaters (EPA/625/R-99/010) [R]. Cincinnati, Ohio: Office of Research and Development, National Risk Management Research Laboratory, 1999.
[15] CRAFT C B, BROOME S W, SENECA E D, et al. Estimating sources of soil organic matter in natural and transplanted estuarine marshes using stable isotopes of carbon and nitrogen[J]. Estuar Coast Shelf Sci, 1988, 26: 633-641
[16] ODUM W E, HEYWOOD M A. Decomposition of intertidal freshwater marsh plants[A]. In: GOOD R E, WHIGHAM D F, JR SIMPSON R L, eds. Freshwater Wetlands: Ecological Processes and Management Potential[C]. San Diego, CA: Academic Press, 1978: 89-97.
[17] DAVIS C B, VAN DER VALK A G. Uptake and release of nutrients by living and decomposing Typha glauca tissues at Eagle Lake, Iowa[J]. Auat Bot, 1983, 16: 75-89.
[18] MEUTIA A A. Treatemnt of laboratory wastewater in a tropical constructed wetland comparing surface and subsurface flow[J]. Wat Sci Tech, 2001, 44(11-12): 499-506.
[19] REDDY K R, GRAETZ D A. Carbon and nitrogen dynamics in wetland soils[A]. In: HOOK D D, et al. eds. The Ecology and Management of Wetlands[C]. Portland OR: Timber Press, 1988: 307.
[20] GACHTER R, MEYER J S. The role of microorganisms in mobilization and fixation of phosphorus in sediments[J]. Hydrobiologia, 1993, 253: 103-121.
[21] REDDY K R, KADLEC R H, FLAIG E, et al. Phosphorus assimilation in streams and wetland: critical reviews[J]. Environ Sci Tech, 1996, 31: 4-18.
[22] WANG N M, WILLIAM J M. A detailed ecosystem model of phosphorus dynamics in created riparian wetlands[J]. Ecol Eng, 2000,
126: 101-130.
[23] 吴振斌, 梁威, 成水平. 人工湿地植物根区土壤酶活性与污水净化效果及其相关分析[J]. 环境科学学报, 2001, 21(5): 622-624.
[24] GREENWAY M. Nutrient content of wetland plant in constructed wetland[J]. Wat Sci Tech, 1997, 35(5): 135-142.
[25] BRIX H. Use of constructed wetland in water pollution control: historical development presentstatuse and future perspectives[J]. Wat
Sci Tech, 1994, 30(8): 209-223.
[26] STEWART J W B, TIESSEN H. Dynamics of soil organic phosphorus[J]. Biogeochemistry, 1987, 4: 41-60.
[27] REDDY K R, D‘ANGELO E M. Biogeochemical indicators to evaluate pollutant removal efficiency in constructed wetlands[J]. Wat Sci Tech, 1997, 35(5): 1-10.
[28] REED S C, CRITES R W, MIDDLEBROOKS E J. Natural systems for waste management and treatment[M]. The Second Edition. New York: McGraw Hill Inc., 1995.
[29] KIM S Y, GEARY P M. The impact of biomass harvesting on phosphorus uptake by wetland plants[J]. Wat Sci Tech, 2001, 44(11-12): 61-67.
[30] TANNER C C. Substratum phoshorus accumulation during maturation of gravel-bed constructed wetlands[J]. Wat Sci Tech, 1999, 40(3): 147-154.
[31] STUMM W, MORGAN J J. Aquatic Chemistry: An Introduction Emphasizing Chemical Equilibria in Natural Waters[M]. New York: John Wiley & Sons, 1970: 583.
[32] RICHARDSON C J. Mechanisms controlling phosphorus retention capacity in wetlands[J]. Science, 1985, 228: 1 424-1 427.
[33] MITSCH W J, GOSSELINK J G. Wetlands[M]. The Second Edition. New York: Van Nostrand Reinhold, 1993.
[35] DRIZO A, FROST C A. Physico-chemical screening of phosphate removing substrates for use in constructed wetland systems[J]. Wat Res, 1997, 33(7): 3 595-3 602.
Mechanism of nitrogen and phosphorus removal in free-water surface constructed wetland
ZHANG Jun, ZHOU Qi, HE Rong
College of Environmental Science and Engineering, Tongji University, Shanghai 200092, China
Abstract: The mechanism of nitrogen and phosphorus compound removal by the biological, physical and chemical processes in the free-water surface constructed wetlands is reviewed in this paper. Denitrification and sedimentation to the soil are widely accepted as the main pathways through which nitrogen and phosphorus are removed from the wastewater by free-water surface constructed wetlands, but there are significant differences among different researches, and further researches are still required to get detailed information of these processes and pathways for establishing the ecosystem dynamic models, in order to design and predict the performance of free-water surface constructed wetlands, and enhance its application to wastewater treatment.
Key words: constructed wetland; nitrogen; phosphorus; removal mechanism
论文搜索
月热点论文
论文投稿
很多时候您的文章总是无缘变成铅字。研究做到关键时,试验有了起色时,是不是想和同行探讨一下,工作中有了心得,您是不是很想与人分享,那么不要只是默默工作了,写下来吧!投稿时,请以附件形式发至 paper@h2o-china.com ,请注明论文投稿。一旦采用,我们会为您增加100枚金币。








